書類
documents
- 受付
- 事前面接
- ヒヤリング/プロトコル合意
- IRB資料の提出
- 治験審査委員会
- 契約締結
- スタートアップミーティング
| 手続き | 担当窓口 |
|---|---|
| 開発企業は事務局へ相談 | 事務局 |
|
治験責任医師へ治験依頼 治験事務局(実施の調整・手続き説明) |
事務局 |
|
ヒヤリング 治験責任医師とプロトコル合意 →合意後、治験依頼書(書式3)提出 |
事務局 |
|
上記をファイルしたもの16部を予定IRBの14日前までに提出 1.治験実施計画書 2.症例報告書の見本(治験実施計画書で読み取れる場合、不要) 3.治験薬概要書 4.被験者の安全等に係わる報告 5.被験者への支払いに関する資料(ある場合) 6.健康被害に対する補償に関する資料 7.治験分担医師氏名 リスト(参考書式5) 8.履歴書(書式1(写)) 9.同意・説明文書 10.被験者の募集手順(広告等)に関する資料(ある場合) 11.その他、審査に必要なもの ※契約書についても、IRBを目安にご準備ください |
事務局 |
| 毎月第3金曜日 | 事務局 |
|
契約書・覚書(必要な場合) 2者間契約の場合: 2部 |
企画課 |
|
開発企業・医師・院内関連部署が参加 治験薬搬入・検査資材搬入の調整をお願いします。 |
事務局 |
- 治験実施計画書変更等
- 直接閲覧
| 手続き | 担当窓口 |
|---|---|
| 治験責任医師との合意 IRB審査に必要な書類を準備し提出 |
事務局 |
|
事前にmail等を利用し確認のうえ、直接閲覧実施連絡票 (参考書式2)を提出 |
事務局 |
当院では、「新たな治験活性化5カ年計画に基づき、2008年4月より統一書式を採用しております。
「厚生労働省HP」より入手をお願いいたします。
| 統一書式番号 | 資料名 |
|---|---|
| 別紙様式1-3 | |
| 別紙様式2 |
器の管理手順書
equipment used in clinical trials
究の流れ&関連書
類
than clinical trials & related
documents
平成23年4月1日に「治験以外の受託研究に係る標準業務手順書」を作成しました。
研究委託のお申込の際には「治験以外の受託研究に係る標準業務手順書」を確認のうえご連絡ください。
- 受付
- 事前調整
- IRB資料の提出
- IRB審査
- 契約締結
- 契約開始
- 研究終了
| 手続き | 担当窓口 |
|---|---|
|
治験以外の受託研究の依頼者は、研究責任者へ相談 ・ 研究責任者へ、資料(研究実施計画書、調査票見本等)を提供 ・ 研究責任者と、研究および契約の内容等について調整 |
研究責任者 |
|
関連書類(様式)を入手 |
事務局 |
|
研究委託申込に必要な書類の準備
1. 研究委託申込書[様式1] (1部)
【契約書作成に関するお願い事項】 3. 受託研究経費算出用紙[別紙1または別紙2] (16部)
4. 研究実施計画書(実施要綱) (16部) 上記の赤字の書類は事前(捺印等の処理前)に調整が必要なため、研究内容がわかる資料をご持参、または、メール添付のうえご連絡ください。 |
事務局 |
| 上記書類を予定IRBの14日前までに提出 | 事務局 |
| IRB開催 (開催日:毎月第3金曜日) | 事務局 |
| 契約締結 | 事務局 |
|
研究用資材の搬入 研究実施計画書(実施要綱)、調査票、調査票記入ガイド、検査容器等、研究に必要な資材を研究責任者へ提供 |
研究責任者 |
|
必要な情報は研究責任者へ連絡 研究中は、研究依頼者と研究責任者で連絡し、研究内容等の調整をしてください。 |
研究責任者 |
|
※研究中に以下の事項が発生した場合、ご連絡ください。 ・ 契約期間中に研究計画書、契約内容等に変更があった場合 研究実施計画書等の変更の場合は、事前に研究責任者の合意を得てから変更申請してください。 ・ 研究依頼者が研究の中止・中断を決定した場合 ・ 研究期間が1年を超える研究の場合 |
事務局 |
| 調査票の回 | 研究責任者 |
| 企画課へ調査票(写)又は調査票(写)に準ずるものの1部を提出 企画課は、調査票(写)又は調査票(写)に準ずるものを受領後、研究費の請求書を月末発行 |
企画課 |
| 受託研究終了(中止・中断)報告書[様式11]提出 | 事務局 |
| IRBへ終了報告 | 事務局 |
| 書類番号 | 資料名 |
|---|---|
| 様式1 | |
| 様式2 | |
| 様式3-1 | |
| 様式3- | |
| 様式4 | |
| 様式5 | |
| 様式6 | |
| 様式6-3 | |
| 様式7 | |
| 様式8 | |
| 様式9 | |
| 様式10 | |
| 様式11 | |
| 様式12 | |
| 別紙1 | |
| 別紙2 | |
| 別添1 |
案内図
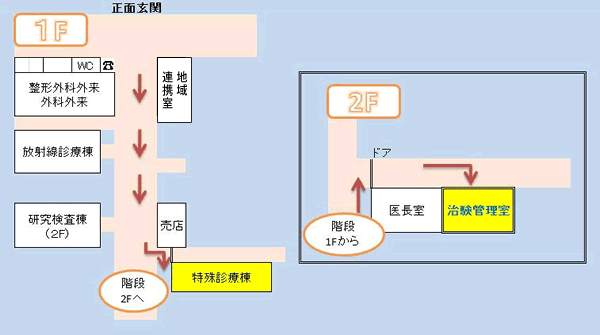
■治験管理室へのお問い合わせ
愛媛医療センター 治験管理室
〒791-0281 愛媛県東温市横河原366番地
TEL:089-990-1929 FAX:089-990-1934
E-mail:520-chiken@mail.hosp.go.jp

