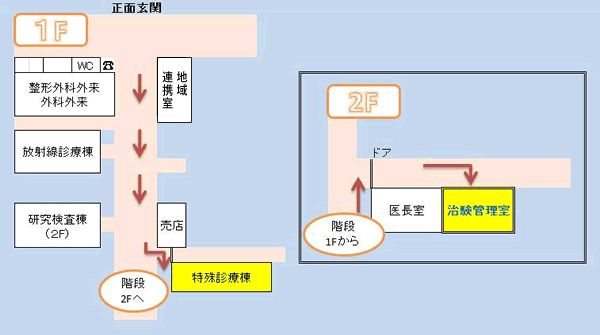
ホーム > 治験管理室 > 依頼者・企業向け > 治験の流れ&関連書類
依頼者・企業向け
標準業務手順書
治験に使用する機器の管理手順書
臨床検査基準値
治験申請時の手続き(愛媛病院治験審査委員会で審査する場合)
| 担当窓口 | ||
|---|---|---|
| 開発企業は事務局へ相談 | 事務局 | |
| 治験責任医師へ治験依頼 治験事務局(実施の調整・手続き説明) |
事務局 | |
| ヒアリング 治験責任医師とプロトコル合意 →合意後、治験依頼書(書式3)提出 |
事務局 | |
上記をファイルしたもの16部を予定IRBの14日前までに提出
※契約書についても、IRBを目安にご準備ください |
事務局 | |
| 毎月第3金曜日 | 事務局 | |
契約書・覚書(必要な場合)
|
企画課 | |
 |
開発企業・医師・院内関連部署が参加 治験薬搬入・検査資材搬入の調整をお願いします。 |
CRC |
国立病院機構中央治験審査委員会対象の場合は手続きが異なりますので、NHO本部治験推進室とご相談のうえ、ご連絡ください。
治験実施中の手続き
| 担当窓口 | ||
|---|---|---|
| 治験責任医師との合意 IRB審査に必要な書類を準備し提出 |
事務局 | |
| 事前にmail等を利用し確認のうえ、直接閲覧実施連絡票(参考書式2)を提出 | 事務局 |